La clé de la régulation de la structure de l’ADN décryptée
L'équipe de recherche dirigée par Valérie Lamour à l'Institut de génétique et de biologie moléculaire et cellulaire (IGBMC - Unistra/CNRS/Inserm) vient de réaliser une percée dans la compréhension de la mécanique moléculaire des topoisomérases de type II, une famille d'enzymes essentielles à la régulation de la structure de l'ADN. Une avancée majeure dans la recherche biomédicale qui ouvre de nouvelles perspectives thérapeutiques.
L’ADN n’est pas tout nu dans les cellules, il est parcouru par différentes molécules lors du cycle de vie cellulaire et cela peut créer des nœuds, ou problèmes topologiques. Le rôle des topoisomérases II consiste à dénouer ces nœuds
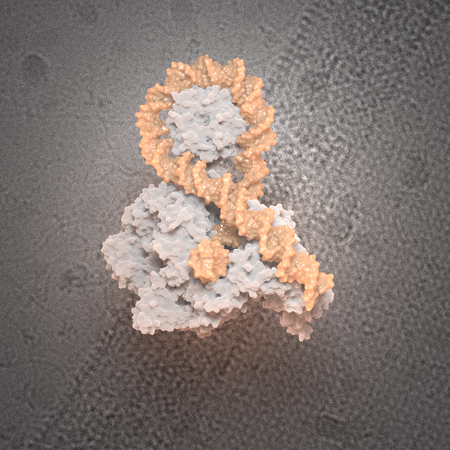
, explique Valérie Lamour. Son équipe travaille depuis longtemps sur la détermination de l'architecture moléculaire de l'ADN gyrase d'E. coli, une topoisomérase bactérienne. Cette enzyme, gigantesque avec ses 400 000 Dalton, est cruciale pour le dénouement des nœuds topologiques dans l'ADN, mais son mécanisme d'action n’avait jusqu’à présent jamais été observé.
Pour ce faire, les scientifiques ont eu recours à une technologie ingénieuse : la création de mini-cercles d’ADN surenroulés afin d’imiter le chromosome bactérien, astuce pour laquelle ils ont bénéficié de l’expérience de leurs collaborateurs de l’équipe du Dr Lynn Zechiedrich (Baylor College of Medecine Houston, USA). Par différentes étapes biochimiques, ils ont introduit dans ce mini-cercle des torsions qui conduisent à des enchevêtrements et croisements de la double hélice d’ADN sur elle-même, similaires à ceux observés dans les processus cellulaires normaux, mais amplifiés pour les besoins de l'expérimentation.
Une étape du mécanisme jamais observée auparavant
Avec Marlène Vayssières, chercheuse post-doctorante de mon équipe, nous avons mimé ce mécanisme in vitro et mis cet ADN surenroulé en présence de l’enzyme bactérienne
, décrit la chercheuse. Nous avons ensuite bénéficié de l'expertise de Nils Maréchal, ingénieur CNRS à l’IGBMC, pour accrocher un grand nombre de ces complexes sur les grilles de microscopie, améliorant ainsi considérablement notre capacité à les observer et à analyser leurs interactions avec précision.
Les observations ont également révélé que l’enzyme se fixe préférentiellement sur des croisements d'ADN enroulés positivement
L’équipe de Valérie Lamour a ensuite utilisé Titan Krios, un appareil de microscopie électronique à transmission, afin d’étudier comment la topoisomérase se fixe sur un croisement d’ADN, une étape du mécanisme jamais observée auparavant. Les observations ont également révélé que l’enzyme se fixe préférentiellement sur des croisements d'ADN enroulés positivement.
De nombreuses perspectives thérapeutiques
Il y a deux sens d’enroulement pour l’ADN, positif ou négatif. L’ADN surenroulé chez les bactéries est habituellement surenroulé négativement car cela facilite l’ouverture de la double hélice et permet un accès facilité à l’information génétique par les différentes machineries cellulaires. Le surenroulement positif au contraire limite l’ouverture de la double hélice et bloque les machineries. Nous avons choisi de générer un surenroulement négatif pour nos mini-cercles d’ADN. Or nous avons observé que l’enzyme a fixé un croisement positif
, ajoute Valérie Lamour.
Une découverte confirmée par Marc Nadal, collaborateur de l'équipe de recherche à l'ENS Paris - Université Paris Cité, qui s’est appuyé sur une autre technique. Les topoisomérases bactériennes étant des cibles d’antibiotiques et les topoisomérases humaines, des cibles de chimiothérapie, cette découverte ouvre de nombreuses perspectives thérapeutiques.
- Retrouvez le lien vers la publication dans Science et le communiqué de presse.
Video
Mots-clés
Mots-clés associés à l'article :