Réponse aux infections : une nouvelle protéine de défense entre en piste
Chez l’homme, une infection virale induit une réponse pour protéger l’organisme qui se traduit par la production d’une molécule signal : l’interféron. Ce dernier induit l’expression de nombreux gènes pour lutter contre les pathogènes, dont des ribonucléases chargés de dégrader des ARNs viraux et/ou des ARN cellulaires. Dans une étude publiée dans Nucleic Acids Research, Bertrand Séraphin et son équipe de l’Institut de génétique et de biologie moléculaire et cellulaire (IGBMC – CNRS/Inserm/Unistra) caractérisent une nouvelle ribonucléase et démontrent que sa synthèse utilise un mécanisme non-conventionnel.
Suite à une infection virale, comme celle produite par le SARS-Cov2, les cellules vont synthétiser des petites protéines de signalisation, les interférons, qui vont induire de profonds changements dans les cellules infectées et les cellules voisines afin de stimuler des mécanismes de défense et de bloquer la propagation du virus.
Ainsi, des centaines de gènes sont activés pour interférer avec la production de nouvelles particules virales. Les fonctions d’une large proportion des protéines induites restent encore inconnues. Parmi celles-ci, les ribonucléases jouent un rôle clé en éliminant les ARN viraux et/ou en permettant aux cellules d’adopter un programme défensif.
Dans cette étude, les scientifiques déterminent les fonctions biochimiques d’une protéine induite par l’interféron : HELZ2. Contrairement à ce que laissait penser les séquences déposées dans les banques de données, les scientifiques montrent que la synthèse de HELZ2 commence avec un codon d’initiation de la traduction non-conventionnel GUG, ce qui change la protéine produite.
Une ribonucléase supplémentaire dans l’arsenal de défense
Celle-ci est de très grande taille, 2 947 acides aminés, avec plusieurs domaines fonctionnels suggérant des interactions avec l’ARN. Cependant, comme le domaine nucléase de HELZ2 diverge du consensus, la communauté pensait qu’il était inactif. Prenant le contre-pied de cette prédiction, les scientifiques démontrent que HELZ2 est une ribonucléase qui dégrade ses substrats de leur extrémité 3’ vers leur extrémité 5’.
La présence de deux domaines hélicase permet, en concertation avec le domaine ribonucléase, la dégradation d‘ARN structurés qui sont typiquement retrouvés dans les génomes viraux.
L’ensemble des résultats montre la présence d’une ribonucléase supplémentaire dans l’arsenal de défense déployé par les cellules humaines en réponse aux infections virales. L’identification des cibles de HELZ2 permettra, par la suite, de mieux comprendre son rôle dans la réponse contre les pathogènes.
Explications en image
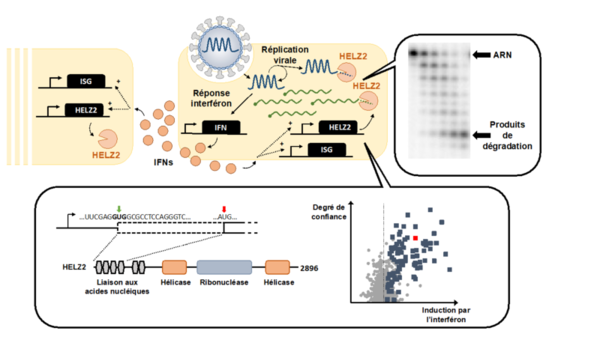
La réponse interféron se déclenche lorsqu’une cellule (symbolisée en jaune) détecte les acides nucléiques viraux, ce qui entraine la synthèse et la sécrétion de molécules d’interférons dans le milieu extracellulaire. Ces interférons vont se lier à des récepteurs membranaires pour activer une voie de signalisation cellulaire qui permet l’induction d’une centaine de gènes pour lutter contre l’infection virale dans la cellule infectée et les cellules voisines. Cette étude confirme que parmi les gènes induit par l’interféron (gènes ISG pour Interferon-Stimulated Genes, en bleus sur le graphique) se trouve celui codant pour la protéine HELZ2 (en rouge sur le graphique). L’étude montre également que la synthèse de cette protéine démarre par un codon d’initiation de la traduction non-conventionnel (flèche verte) localisé bien en amont du codon conventionnel (flèche rouge). Au sein de HELZ2 se trouvent plusieurs domaines impliqués dans le métabolisme des acides nucléiques dont un domaine ribonucléase. L’étude révèle que HELZ2 est bien une nucléase active et qu’elle est capable de dégrader des ARN structurés. L’identité de ses substrats naturels, acides nucléiques d’origine virale ou cellulaires, reste encore à déterminer.
Mots-clés
Mots-clés associés à l'article :