Quand la construction des complexes protéiques et la synthèse des protéines se produisent simultanément
L’activité de nos cellules est régulée par de multiples complexes multiprotéiques, essentiels pour leur fonctionnement. Dans une étude publiée dans Nature Structural & Molecular Biology, l'équipe de László Tora, chercheur à l’Institut de génétique et de biologie moléculaire et cellulaire (IGBMC – CNRS/Inserm/Unistra), étudie les mécanismes moléculaires de l’assemblage d’un complexe multiprotéique impliqué dans l’activité de nos gènes. Les chercheurs montrent que ce dernier commence à être assemblé dès l’étape de conversion de l’ARN en protéine, éclairant une stratégie qui pourrait être répandue parmi ces complexes.
La plupart des machineries protéiques qui régulent les fonctions cellulaires sont constituées de plusieurs sous-unités protéiques, souvent très différentes. L'efficacité de l’assemblage de ces complexes protéiques est indispensable pour réduire les interactions non spécifiques, l'agrégation des protéines et leur mauvaise localisation dans la cellule. L’organisation d’une cellule peut être décrite comme une énorme boîte de jeux de construction, où une seule brique peut rencontrer et interagir avec de nombreuses autres briques aléatoires dans la foule avant de trouver ses partenaires naturels et de participer à l'assemblage d'un élément complexe. La question est de savoir comment les cellules sont capables d'assembler de manière autonome et efficace des machineries protéiques complexes.
De nombreux exemples de ces complexes protéiques sont des facteurs clés impliqués dans la régulation de l'expression des gènes dans le noyau de nos cellules. Parmi eux, le facteur général de transcription TFIID (20 sous-unités) a été largement étudié pour son rôle central dans le pilotage de l'expression de tous les gènes codant pour des protéines, mais l'endroit et la manière dont ce complexe se construit dans la cellule restaient une énigme non résolue.
Une plate-forme d'atterrissage pour l'assemblage des protéines
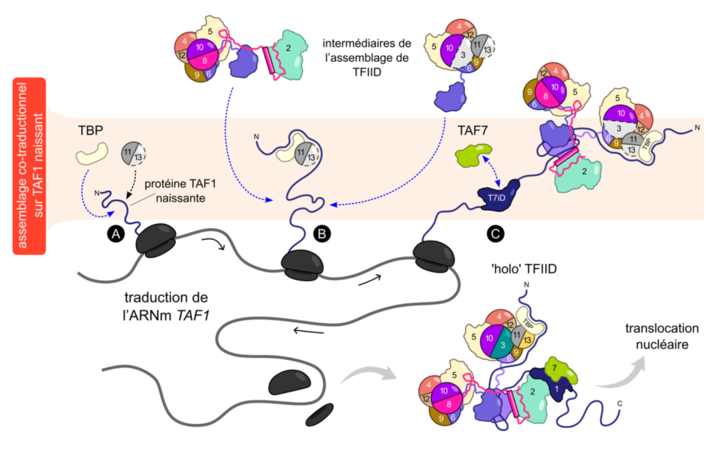
Dans cette étude, les scientifiques ont étudié les étapes d'assemblage de TFIID dans des cellules humaines en utilisant une série d'approches expérimentales complémentaires. Ainsi, ils montrent que la plupart des étapes d'assemblage se produisent avant l'achèvement de la synthèse des protéines, lors d’un processus appelé assemblage co-traductionnel.
Ces résultats montrent que l’assemblage hiérarchisé est une stratégie efficace
L'ensemble des éléments simples du complexe est construit lorsque des sous-unités individuelles s'engagent dans la chaîne naissante de leurs partenaires spécifiques sur les ribosomes. Ces intermédiaires sont stockés dans le cytoplasme de la cellule et participent à la dernière étape d'assemblage sur la chaîne naissante de la plus grande sous-unité du complexe, TAF1. Les auteurs ont découvert que cette sous-unité fonctionne comme une plate-forme d'atterrissage pour l'assemblage des protéines. Ainsi, une fois la traduction de TAF1 terminée, un complexe complet TFIID est libéré et transloqué dans le noyau.
Ces résultats montrent que l’assemblage hiérarchisé, se produisant en même temps que la synthèse des protéines, est une stratégie efficace. Ils permettent également aux scientifiques d’émettre l’hypothèse qu’il s’agirait d’une stratégie répandue parmi les grands complexes protéiques de la cellule.
- Retrouvez l'article dans Nature structural and molecular biology
Mots-clés
Mots-clés associés à l'article :