PARP3, une cible thérapeutique dans le traitement des cancers agressifs
Françoise Dantzer, son doctorant Léonel Nguekeu-Zebaze, et son équipe de l’unité mixte de recherche Biotechnologie et signalisation cellulaire (CNRS/Unistra), révèlent PARP3 comme une nouvelle enzyme responsable de l’agressivité des cancers. Financé par le Labex Medalis, l’Institut thématique interdisciplinaire (ITI) Institut du médicament de Strasbourg (IMS) et la région Grand Est, ce travail prometteur permet de proposer PARP3 comme cible thérapeutique dans le traitement de ces cancers.

Les PARP, pour Poly(ADP-ribose) polymérase, sont des enzymes impliquées dans la régulation des protéines. Il en existe 17 au total parmi lesquelles PARP3. Nos recherches initiales avaient déjà identifié PARP3 comme un élément déterminant de l’
, explique Françoise Dantzer.agressivité des cancers du sein
. Dans ce dernier travail, nous montrons qu’elle contribue aussi à l’agressivité du glioblastome, un cancer du cerveau particulièrement dévastateur. Ce qui appuie encore plus l’intérêt de la cibler avec des outils thérapeutiques innovants
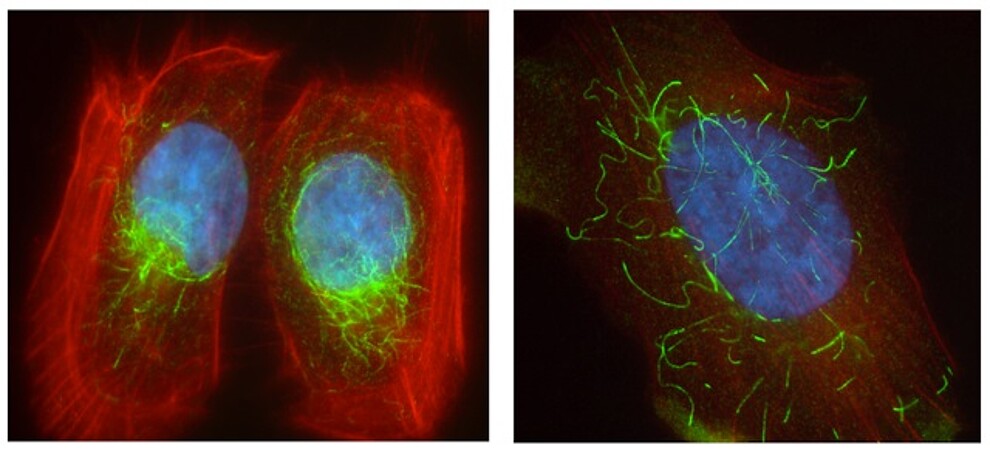
Son fonctionnement ? PARP3 inhibe l’activité de G9A, une protéine de la chromatine dont l’activité enzymatique permet de freiner l’expression de certains gènes impliqués dans l’agressivité de la tumeur. Lorsque PARP3 est retirée des cellules ou inactivée, G9A peut faire son travail et inhiber l’expression de ces gènes, ce qui dérange certaines propriétés tumorales. Son action induit également une forte fragilité des microtubules, des fibres du squelette cellulaire, qui ont un rôle important dans la dynamique et la division cellulaire. Cette fragilité peut être exploitée car elle rend les cellules cancéreuses plus sensibles aux drogues qui déstabilisent les microtubules.
Un anticorps transportant un médicament
Partant de ce constat, sous l’impulsion de l’ITI IMS, les chercheurs se sont associés à l’équipe de Chimie biofonctionnelle d’Alain Wagner pour construire un outil permettant à la fois d’inhiber PARP3 et de déstabiliser les microtubules.
Ils optent pour l’utilisation d’un anticorps transportant un médicament. Nous avons greffé sur le Trastuzumab, un anticorps déjà utilisé dans le traitement du cancer du sein, d’une part un ARN interférant ciblant PARP3 pour empêcher son expression, et d’autre part la Vincristine, une drogue qui fragilise les microtubules.
Notre preuve de concept dans le cancer du sein est actuellement en validation
Objectif : montrer que leur outil permet de tuer les cellules cancéreuses. Notre preuve de concept dans le cancer du sein est actuellement en validation.
Les recherches sur PARP3 se poursuivent par ailleurs. Cela permettra de connaitre les points de vigilance à avoir en cas d’utilisation de notre traitement. Nous avons notamment découvert que l’absence de PARP3 sensibilisait les souris, notre modèle d’étude in vivo, aux conditions hypoxiques, un équivalent des accidents vasculaires cérébraux chez l’humain.
- Retrouvez la publication dans Scientific report.
Un peu d'histoire...
L’intérêt de Françoise Dantzer pour PARP3 est né il y a une dizaine d’années. A l’époque, la recherche s’intéressait à PARP1 montrant qu’elle possédait un rôle déterminant dans la réparation des cassures de l’ADN. Dans le traitement actuel du cancer par radiothérapie ou certaines chimiothérapies, l’objectif est justement de générer des cassures dans l’ADN pour tuer la cellule cancéreuse. Inhiber PARP1, c’est empêcher la réparation de ces cassures pour améliorer l’action des traitements. Plusieurs inhibiteurs PARP1 sont en essai clinique de phase 3 et révèlent leur efficacité. Ils sont donnés en complément de la radiothérapie ou de la chimiothérapie pour empêcher cette réparation des cassures.
Ces inhibiteurs de PARP1 s’attaquent également aux autres PARP. Il est donc nécessaire de décortiquer leurs fonctions.
Mots-clés
Mots-clés associés à l'article :